全球第二款!中国自主研发13价肺炎结合疫苗上市,价格更低、接种年龄跨度更大
此次获得批准的13价肺炎球菌多糖结合疫苗是该品种首个自主研发生产的国产疫苗,同时也是全球第二个同类型产品。由此,辉瑞独享我国13价肺炎球菌多糖结合疫苗市场的状况将被打破。据业内专家分析,该品种疫苗国内市场空间有望达到每年约80亿元。
每经记者 周程程 每经编辑 陈旭
12月31日,国家药监局网站发布消息显示,近日,国家药监局批准玉溪沃森生物技术有限公司申报的13价肺炎球菌多糖结合疫苗(以下简称13价肺炎结合疫苗)上市注册申请。这意味着首个国产13价肺炎结合疫苗获批上市。
此次批准的13价肺炎球菌多糖结合疫苗是该品种首个自主研发生产的国产疫苗,同时也是全球第二个同类型产品。由此一来,过去辉瑞独享我国13价肺炎球菌多糖结合疫苗市场的状况将被打破。
据启信宝信息显示,玉溪沃森生物技术有限公司为上市公司云南沃森生物技术股份有限公司(300142,收盘价32.44元,以下简称“沃森生物”)的控股子公司。
沃森生物董秘办公室相关工作人员对《每日经济新闻》记者表示,拿到国家药监局的生产批件后,公司将尽快组织生产,由于报批签发还需大约3个月,所以从目前到疫苗最终能够接种,预计还需要3个月以上的时间。
2018年,我国新生儿数量超过1500万,对该疫苗有着巨大的临床需求。目前,更多国产企业正谋求进入市场。例如,12月9日,康泰生物(300601,收盘价87.78元)全资子公司北京民海生物科技有限公司研发的13价肺炎球菌结合疫苗申请新药生产注册,已经获得国家药监局出具的《受理通知书》。
图片来源:新华社
世卫组织推荐接种13价肺炎结合疫苗
肺炎球菌是引起侵袭性疾病、肺炎和上呼吸道感染的主要原因。严重的肺炎球菌疾病还可能导致耳聋、瘫痪、智力低下等严重后遗症。肺炎球菌疾病是导致5岁以下儿童发病和死亡的主要病种,据世卫组织估计,全球每年约有160万人死于肺炎球菌感染,其中有70万到100万为5岁以下儿童。
世卫组织将儿童肺炎球菌疾病列为需高度优先使用疫苗预防的疾病,并推荐使用13价肺炎结合疫苗进行接种。
目前,全球已上市的13价肺炎球菌结合疫苗仅美国辉瑞(惠氏)公司生产,自2010年批准上市以来独享整个市场。数据显示,2018年辉瑞的13价肺炎结合疫苗的全球销售额为58亿美元。
2016年10月,辉瑞13价肺炎结合疫苗在我国获批上市,并于2017年3月正式签发投入市场。据披露,2018年辉瑞13价肺炎疫苗在国内获得批签发量384.8万支,产值总额约为26.86亿元。
这样的产值水平是基于供不应求的情况下呈现的,考虑到我国的实际需求量更大,因此还留下了广阔的市场空间。
莫尼塔研究于2019年1月发布的一份研报曾对13价肺炎疫苗市场空间进行估算,其依据中国2017年新出生人口为1728万,并假设该疫苗在农村新生儿中接种率为20%,并在城镇新生儿中达到40%接种率,得出该疫苗年需求量可达到2191.2万支。假设国产疫苗定价为400元/支,市场空间约可达到87.65亿元。
国产疫苗接种年龄跨度更大
辉瑞13价肺炎结合疫苗在我国批准用于6周龄至15月龄婴幼儿。有行业人士接受《每日经济新闻》记者采访时表示,接种该疫苗,需要在6月龄之前接种第一针。也就是说,一旦婴幼儿超过6月龄,或因身体等原因错过第一针开针时间,便无法接种,从而导致婴幼儿暴露在肺炎球菌感染风险中。
该人士表示,婴幼儿需要接种的疫苗种类很多,原本就是需要找空当去接种13价肺炎结合疫苗这种二类苗。同时,接种前需要对孩子进行检查,如果不是完全健康的状况则不能接种。这种情况下,其实很容易错过6月龄的第一针。
此次批准国产13价肺炎结合疫苗则因接种年龄跨度更大,能够更加灵活地进行接种。与此同时,接种窗口期的延长也有利于增加接种人数。
据药监局信息显示,国产13价肺炎结合疫苗主要用于6周龄至5岁(6周岁生日前)婴幼儿和儿童,预防肺炎球菌1型、3型等13种血清型肺炎球菌引起的侵袭性疾病。
另一方面,国产疫苗还具有价格优势。《每日经济新闻》记者采访获悉,在一些接种点,现有的疫苗价格为730多元一针,而完成接种共需打4针,若全部接种,价格接近3000元。
沃森生物董秘办公室相关工作人员对《每日经济新闻》记者表示,公司新获批产品的定价肯定不会比辉瑞高,但也不会太低。“我们会有一定的价格优势。”
沃森生物日K线图
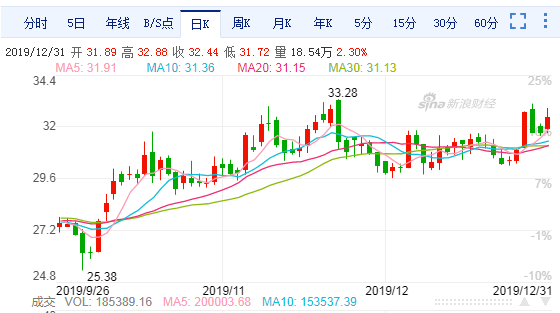
截至12月31日收盘,沃森生物股价报32.44元,单日涨幅为2.30%。近5个交易日以来,公司股价在30.31元~33.08元之间震荡,以上涨为主。
康泰生物最快2020年有望分羹市场
首个国产13价肺炎结合疫苗获批上市,将打破辉瑞独享中国市场的格局。值得注意的是,更多的国内企业正谋求布局市场,其中包括兰州生物制品研究所、康希诺生物、民海生物、北京科兴中维、博沃生物和安特金生物等。
目前,民海生物被认为是与辉瑞、沃森生物最接近的竞争者。作为康泰生物全资子公司,12月9日,民海生物研发的13价肺炎球菌结合疫苗申请新药生产注册,并已获得国家药监局出具的《受理通知书》。
太平洋证券研报指出,康泰生物公司13价肺炎从2004年开始立项,2014年获批进入临床,2016年9月开启PCV-13临床3期,试验方案是与辉瑞的PCV-13进口品种头对头的临床研究,2019年1月揭盲,2019年6月临床总结报告完成,经过预沟通后,2019年10月申报生产,2019年12月获药监局受理,标志着产品开启技术审评流程。
根据国家药品注册管理相关法规,康泰生物13价肺炎球菌结合疫苗申请新药生产注册获得受理后,还需经过技术审评、临床试验现场核查、生产现场检查等程序方可获得批准。
此前,沃森生物公司的13价肺炎结合疫苗于2018年2月1日获得申报生产的《受理通知书》,并于同年4月9日正式纳入优先审评品种。
中泰证券预计,如果进度顺利,康泰生物产品有望于2020年获批上市、2021年开始贡献较大增量业绩,从而得以分享国内巨大的潜在市场。
康泰生物日K线图
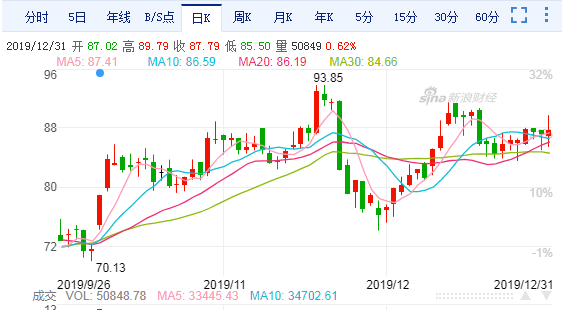
截至12月31日收盘,康泰生物股价报87.79元,单日涨幅为0.62%。近5个交易日以来,公司股价在83.62元~89.79元之间震荡。
药物临床试验登记与信息公示平台信息显示,兰州生物的同品种疫苗处于III期临床阶段,已评估其在2月龄(最小6周)、3月龄及7月龄~5周岁健康婴幼儿接种后安全性与免疫原性。
此外,康希诺生物和北京科兴中维的品种则处于批准临床的状态;博沃生物和安特金生物处在临床申请阶段。